NF
播报
编辑
NF-κB家族成员
NF-κB家族成员与逆转录病毒癌蛋白v-Rel有结构上的同源性,因此将他们归类为NF-κB/Rel蛋白。在哺乳动物中该家族有5种蛋白,分别为:RelA(p65),RelB,c-Rel,NF-κB1(p50)和NF-κB2(p52)。它们的N端有着高度保守Rel同源区(Rel homology region,RHR),RHR由N端结构域(N-terminal domain,NTD)和C端结构域(C-terminal domain,CTD)连接而成,在CTD上有一个核定位区域(nuclear-localization sequence, NLS),负责与DNA结合、二聚体化和核易位。
结构与组成
NF-κB普遍存在于几乎所有动物的各类细胞中,通常以二聚体形式存在,有同源二聚体,也有异源二聚体。构成这类二聚体的单肽蛋白有五种,即:P50(NF-κB1)、p52(NF-κB2)、RelA(p65)、RelB和c-Rel,他们共同组成长度约300个氨基酸的N端Rel同源结构域(RHD) [4],其中包含二聚体化结构域、IκB结合位点、核定位信号和DNA结合部位。不同的NF-κB/Rel蛋白双双结合形成不同的NF-κB转录因子,如P50/P65、P65/c-Rel和P50/P65等,其中以P50/P65发现最早,分布和作用也最广泛 [8]。
其中,RelA(p65)、c-Rel和RelB的C端存在反式激活结构域(transactivation domain,TAD)使其激活目标基因。p50和p52只有RHR而缺乏TAD,因此,p50和p52同源二聚体并不能激活基因转录,只能通过与p65、cRel或RelB的异源二聚化,通过与κB位点的竞争性结合,或通过与非rel转录因子(包括某些IκB蛋白)的异源相互作用来影响转录,其通常产生抑制作用 [4]。它们在细胞内通常各自以其前体p105和p100的形式存在。 [1]
NF-κB与其他物质的结合
播报
编辑
NF-κB- DNA复合物
NF-κB结合DNA的结构最早是在成熟B细胞免疫球蛋白κ-轻链基因的增强子上被发现,两个亚基形成的同源和/或异源二聚体与靶基因上10bp特定的序列(-κB 位点)结合调节基因转录,不同的NF-κB二聚体在选择结合序列时可能略有差异,这是NF-κB通过不同的二聚体的形式对不同基因的表达进行精细调节的一种方式,但结合的模式基本相同。NF-κB的两个RHR组装成蝴蝶样结构,中间有一个孔可以让DNA穿过。CTD负责两个蛋白的二聚,以及DNA的磷酸化,NTD可以特异性识别DNA碱基序列以及非特异性结合DNA的磷酸骨架。
最常见的NF-κB二聚体是RelA(p65)与 p50组成的异二聚体。 [1]
NF-κB抑制蛋白IκB
静息状态的NF-κB通常与κB抑制剂(IκB)结合以防止与靶点结合。
NF-κB二聚体的抑制蛋白家族(IκB)目前有八种,分别是传统的IκB蛋白(IκBα,IκBβ,IκBε),NF-κB前体蛋白(p100,p105),以及核IκB(IκBζ , Bcl-3, and IκBNS) [5]。
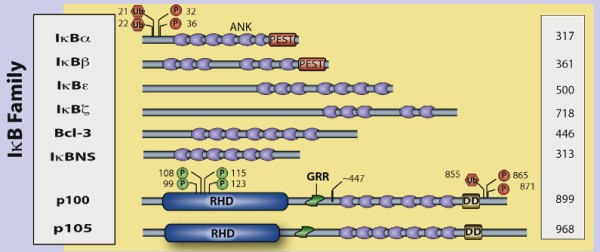 IκB家族
IκB家族
IκB调控NF-κB的功能具有高度灵活性,IκB能够与细胞质及细胞核中的NF-κB二聚体结合,进而增强或抑制转录过程。IκB通过其C末端特定的锚蛋白重复序列(ankyrin repeat–containing domain ,ARD)与NF-κB结合,并覆盖NLS阻止NF-κB向细胞核内转移。
由于在其C末端半部存在锚蛋白重复,p105和p100也起IκB蛋白的作用。p100的c-末端一半(通常称为IκBδ)也起抑制剂的作用。IκBδ响应发育刺激而降解,例如通过LTβR转导的刺激,在NIK依赖的非经典途径中加强NF-κB二聚体活化。 [1]
NF-κB通路的作用
播报
编辑
NF-κB信号通路的激活
NF-κB能够被多种刺激激活,例如:免疫受体如Toll样受体和抗原受体、细胞因子、佛波脂、生长因子、氧化应激、短波紫外线等 [6]。而激活过程通常分为经典通路、非经典通路和其他通路,进而开启一连串下游的反应。NF-kB1、RelA、c-Rel均由经典通路激活,而NF-kB2、RelB由旁路通路激活,此外还有DNA氧化损伤等诱导的非典型通路;p65的翻译后修饰,也调节NF-kB通路活性。
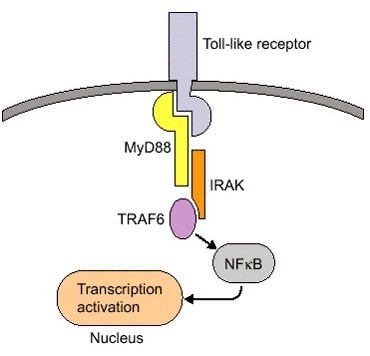 NF-κB信号通路
NF-κB信号通路
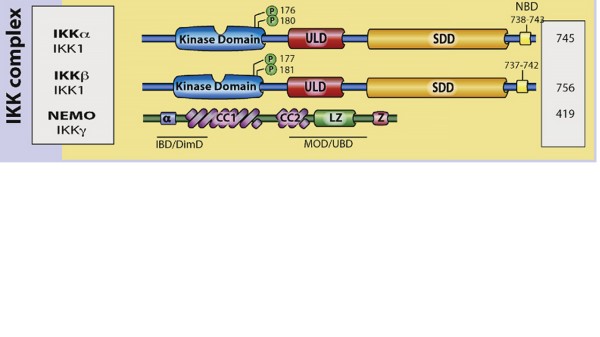 IKK复合物
IKK复合物
经典途径
静息状态下,NF-κB在细胞质中与IκB家族抑制蛋白直接结合。当受到外源性刺激如促炎细胞因子(如TNF-α、IL-1)、病原相关分子模式(如LPS、病毒RNA)等刺激时,通常会启动经典激活途径。当刺激引号传导时,细胞外信号因子与细胞膜上的受体(如TNFR、IL-1R、TLR、TCR等)结合,引发受体三聚化,激活下游激酶,进而导致IκB激酶(IKK复合物)激活,IKK包括IKKα和IKKβ两个IκB激酶 [10
]。IKKβ磷酸化IκB蛋白(如IκBα)的N端特定丝氨酸残基(如Ser32/36),进而被E3连接酶复合物识别,E3连接酶复合物中的β-TrCP导致其多泛素化修饰,最终被蛋白酶降解,从而释放NF-κB二聚体。释放的NF-κB会暴露核定位序列(NLS),转位至细胞核,与特殊靶基因启动子/增强子的κB位点结合,启动转录进程 [7],激活促炎因子(IL-6、TNF-α)、抗凋亡蛋白(Bcl-2、XIAP)等基因表达 [9]。
在经典激活途径中,IKK复合体作为关键调控分子承担核心催化的功能,NEMO为必须调节亚基。整个过程也呈负反馈调节,NF-κB入核后诱导IκBα基因表达,新合成的IκBα进入核内将NF-κB带回胞质,进而终止信号。此外,NF-κB诱导的去泛素化酶A20蛋白降解TRAF6等信号分子,抑制持续激活。
非经典途径
与经典途径不同,当受到CD40配体(CD40L)、B细胞激活因子(BAFF)、淋巴毒素β(LTβ)、RANKL等刺激时,会与其对应的受体如CD40、BAFF受体(BAFF-R)、淋巴毒素β受体(LTβR)等结合进而触发非经典激活途径。受体激活后招募TRAF2/3等衔接蛋白,激活NF-κB诱导激酶(NIK),促进NF-kB诱导的丝裂原蛋白激酶活化,再使蛋白激酶IKKa磷酸化,最终磷酸化NF-κB前体蛋白p100(C端含抑制性结构域),触发其部分蛋白酶体降解,生成成熟的p52。p52能与RelB形成异源二聚体(p52-RelB),转位至细胞核,调控特定靶基因例如:趋化因子(CXCL12)、抗凋亡因子(BCL-2)等,从而参与B细胞存活、淋巴器官发育、骨代谢等 [10
]。
NIK(MAP3K14)是非经典途径的核心激酶,在整个调控过程中起关键作用,其稳定性决定信号强度。静息状态下,NIK被TRAF3-cIAP复合体泛素化降解;激活时TRAF3被降解,NIK稳定积累。
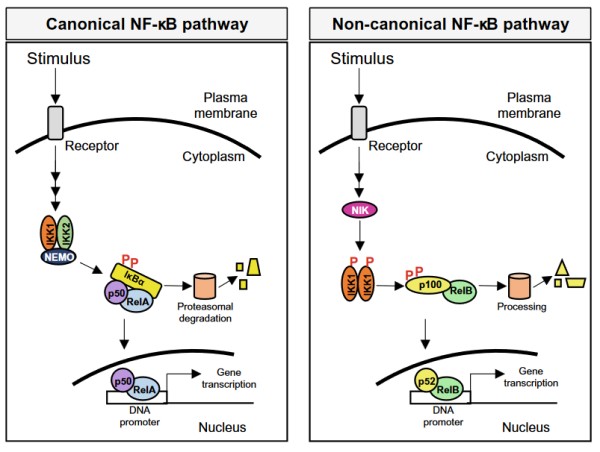 NF-κB的经典途径与非经典途径
NF-κB的经典途径与非经典途径
经典途径与非经典途径的区别
NF-κB的经典途径和非经典途径从刺激到最终的效应均存在较大差异,各自所负责的生物学意义也不同。
通常来说,经典途径的激活速度要快于非经典途径,可以在数分钟内就完成激活,而非经典途径则通常需要数小时。
经典途径主要参与急性炎症与先天免疫,通常能够快速清除病原体,协调全身产生免疫应答。经典途径药物靶点和临床开发较为成熟,目前已有多种抑制剂应用于临床,例如抗TNF-α抗体(如英夫利昔单抗)。但过度激活也可能导致败血症、类风湿性关节炎、癌症等。
非经典途径主要干预淋巴器官发育和适应性免疫调节,与经典途径不同,非经典途径能够精细调控免疫发育,调控B细胞成熟、淋巴结形成,维持免疫稳态,避免急性炎症过度反应。但实际应用上,非经典途径的开发仍存在较大难度。
其他途径
除了经典和非经典途径,NF-κB还可通过一些非典型或交叉途径被激活,如:氧化应激、DNA损伤、病毒直接干预、非编码RNA调控、 代谢通路交叉激活等。
活性氧(ROS)通过激活 ASK1-MAPK通路,间接激活IKK复合体。电离辐射导致DNA损伤,通过ATM激酶 磷酸化NEMO,促进IKK激活。病毒蛋白如:HIV Tat蛋白能够直接结合NF-κB,增强其转录活性;EBV LMP1通过模拟CD40信号,激活经典和非经典途径;而HPV E6/E7通过PI3K/Akt通路激活NF-κB。miR-146a通过负反馈抑制TRAF6/IRAK1,抑制经典途径;miR-155促进IKKε表达,增强NF-κB活性。此外,高血糖/胰岛素抵抗也可能激活NF-κB,晚期糖基化终产物(AGEs)通过 RAGE受体 激活NF-κB,促进糖尿病并发症。
NF-κB通路的基因调控
NF-κB在调节细胞反应中是相当重要的,活化的NF-κB可以与许多基因启动子或增强子上特异的κB序列结合调控这些基因的表达,从而以直接或间接的方式调节机体的生理和病理反应,由于NF-κB已经存在于细胞质中,所以不需要新的蛋白质合成就能被激活(有该特性的其他成员包括c-Jun,STAT和核激素受体),由NF-κB调控的免疫和炎症比其他需要新蛋白合成的反应更有效,它属于“快速作用”的初级转录因子。 [10
]
NF-κB是对有害细胞刺激的第一反应者。已知的NF-κB通路激活的炎症与免疫相关的因子有很多,包括促炎细胞因子(TNF-α、IL-1β、IL-6、IL-12、趋化因子(CXCL8(IL-8)、CCL2(MCP-1)、CCL5(RANTES))、免疫受体(CD80/CD86)、抗原提呈分子(MHC I/II类分子)等 [11]。
细胞存活与凋亡调控基因如:抗凋亡蛋白Bcl-2家族(Bcl-2、Bcl-xL)能够抑制线粒体凋亡途径;c-FLIP能阻断死亡受体介导的凋亡(如Fas信号);XIAP(X连锁凋亡抑制蛋白)能抑制caspase活性 [12]。
此外,锌指蛋白A20、血红素加氧酶-1 (HO-1)等一些抗炎和与细胞凋亡有关的分子如:肿瘤坏死因子受体相关因子-1(tumour-necrosis factor receptor associated factor -1,TRAF-1),抗细胞凋亡的蛋白-1和-2(inhibitor of apoptosis 1/2 , IAP1/ IAP2),TNF 受体相关因子(receptor–associated factors ,TRAF1 /TRAF2),Bcl-2 同源体 A1/Bfl-1和 IEX-IL也都受NF-κB的调控。
促存活信号分子也受到NF-κB的调控,如A20(TNFAIP3)能负反馈抑制NF-κB活性,维持稳态;GADD45β通过促进DNA修复支持细胞存活。
增殖与细胞周期调控基因与NF-κB也有千丝万缕的联系,例如细胞周期蛋白Cyclin D1驱动G1/S期转换,促进细胞增殖;c-Myc调控代谢和增殖相关基因表达。包括生长因子(GM-CSF、VEGF)分别能够刺激粒细胞和巨噬细胞增殖,以及促进血管生成 [14]。
此外,基质金属蛋白酶(MMPs)(MMP-9、MMP-2)能降解细胞外基质,促进炎症细胞浸润和肿瘤转移;而COX-2(环氧化酶-2)能够催化前列腺素合成,介导疼痛和炎症。
许多细菌的代谢产物和各种表面受体的活化导致NF-κB通路的激活,快速改变基因的表达。Toll样受体(Toll-like receptors,TLRs)作为一种特殊的识别分子,它对NF-κB通路的激活增加了对不同病原体激活NF-κB通路的理解。TLR是先天性和适应性免疫应答的关键调节因子 [13]。
抗病毒蛋白如IFN-β能激活干扰素刺激基因(ISGs),抑制病毒复制;RIG-I、MDA5通过识别病毒RNA,触发抗病毒反应。
还有研究证明E选择素、酶(iNOS、COX2、Mn-SOD)、粘附分子(ICAM-1、VCAM-1)、肿瘤相关基因自身免疫病相关基因及ROS调控分子SOD2(超氧化物歧化酶2)等都能够被NF-κB所影响。 [8]
NF-κB的生物学功能
NF-κB是细胞应激、免疫防御和稳态维持的核心调控枢纽,其功能具有高度环境依赖性,其生物学功能主要涉及 [15]:
1.免疫与炎症调控:先天免疫应答及适应性免疫调节。
2.细胞存活与凋亡:主要涉及淋巴器官和骨代谢与重塑。
3.应激与损伤修复:例如氧化应激反应和组织修复及纤维化。
4.各种代谢的调控:糖代谢、与脂质代谢。
5.神经系统功能:如记忆中海马区重塑,神经炎症和退行性疾病等。
6.病理状态下的既可能促进疾病的发生,如促癌作用和自身免疫疾病等,也能够产生抑癌作用和促进自身免疫的作用。
临床应用
播报
编辑
临床疾病
NF-κB的异常激活与多种疾病密切相关,其临床应用主要基于抑制过度激活(如炎症性疾病、癌症)或调节信号平衡(如免疫缺陷)。
临床中主要应用于炎症疾病,如类风湿性关节炎(RA)、炎症性肠病(IBD)、银屑病、哮喘、败血症等;血液肿瘤(多发性骨髓瘤、淋巴瘤)、实体瘤(乳腺癌、结直肠癌、胰腺癌);系统性红斑狼疮(SLE)、干燥综合征、多发性硬化症(MS)等自身免疫性疾病,以及2型糖尿病、非酒精性脂肪性肝炎(NASH)、动脉粥样硬化等代谢性疾病。
药物靶点示例
经典途径:糖皮质激素(抑制NF-κB入核)、IKKβ抑制剂(如TPCA-1)、抗TNF-α抗体(如英夫利昔单抗)。
非经典途径:抗BAFF抗体(Belimumab)、NIK抑制剂(如NIK-SMI1)、RANKL抑制剂(如地诺单抗)。
未来发展方向
播报
编辑
由于NF-κB通路网络极具复杂性,故临床中要求治疗策略兼具精准性和安全性。
在递送策略方面,现有研究不断致力于靶向递送策略例如纳米递送系统,同时也有利用抗体偶联药物(ADC)进行组织特异性递送 [16]。当单一靶点较难实现或存在效果不佳时,联合疗法不但能够通过协同作用提高疗效,还能够通过不同靶点间的相互作用从而降低副作用。此外,基因编辑技术如CRISPR/Cas9敲除特定NF-κB基因,从而用于某些遗传性炎症疾病的治疗中 [17]。
网址:NF https://klqsh.com/news/view/231292
相关内容
Interface engineering of Ni5P2 nanoparticles and a mesoporous PtRu film heterostructure on Ni foam for enhanced hydrogen evolution人心外膜脂肪组织来源因子促进心房内皮功能障碍:促炎细胞因子和 AT1R/NADPH 氧化酶/SGLT2 促氧化剂途径的作用,European Heart Journal
【图片】空气炸锅怎么选?七大品牌选购大梳理,轻松避坑不踩雷!
《中医学报》2024年第39卷 第5期 目录
2025手帐指南:记录生活的点滴
发布人: 发布日期: 2025
研究发现长日照条件下特异性调控水稻抽穗的基因—新闻—科学网
《Nature Water》报道张根教授团队最新研究进展
全球国家简码信息表
简易家电维修技术.ppt

